Unknown Table Periodic Part 3
Cuntenuti
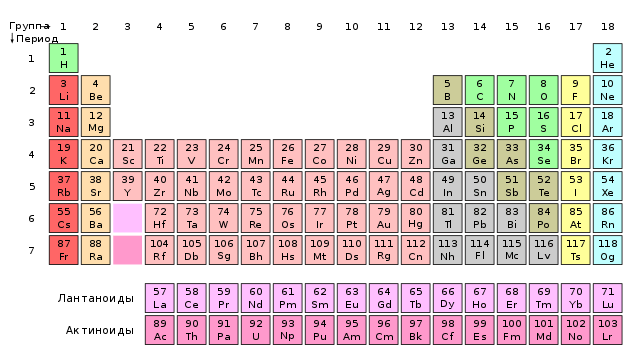
L'ultimu episodiu di l'articulu nantu à a tavola periodica, fora di a scola (currisponde à u titulu di a serie sana). Oghje nantu à i gruppi di solitu trascurati di a tavola periodica, elementi artificiali chì ùn sapemu praticamenti nunda, è ciò chì ci aspetta in l'ottu piriudu.
, dui fila, di solitu posti sottu à a lavagna, sò trattati cun disprezzu à a scola - u maestru solu citarà a so esistenza è passa à altri elementi "più impurtanti". Completamente inadegwate per a funzione chì facenu in u mondu mudernu. Uranu i Plutone () formanu a basa di l'energia nucleare: una fonte affidabile in ogni cundizione climatica (cuntrariu di l'energia non tradiziunale), è quandu hè usata currettamente, hè sicura è ecologica. I lantanidi sò attualmente una materia prima strategica necessaria in parechje tecnulugia avanzata, per esempiu, l'elettronica moderna ùn esisteria micca senza lanthanides. Ma ancu avà, i dui gruppi sò difficiuli di cracke per via di a lege di periodicità.
Prublemu # 1: Lanthanides
Mendeleev cunniscia solu uni pochi di lantanidi è, senza assai difficultà, hà sappiutu à mette in a tavula (1). In l'anni dopu, però, scuperte di tali metalli sfidau a lege di a periodicità. Hè bisognu di elementi successivi per si trovanu in gruppi adiacenti è avè valenze diverse. Intantu, i lantanidi cù massa atomica ligeramente sfarente (chì significava ch'elli avianu da stà unu dopu à l'altru in una fila cuntinua) anu sempre una valenza uguale à III (alcuni ancu II o IV), vale à dì, eranu in u stessu gruppu. Parechje teorie sò state avanzate lantanidi, per esempiu, eranu tutti cunsiderati u stessu elementu in diverse versioni. U prublema hè stata risolta mettendu i lanthanides in una "scatola" di u sistema, ma solu a meccanica quantistica di l'anni 20 è 30 spiegà a so pusizioni in a tavola periodica.
1. Cerium, u lanthanide più cumuni. Tutti l'altri lanthanides sò simili è s'assumiglia à l'aluminiu ()
U prublema cù i lanthanides hè sempre pertinenti oghje. In fatti, ùn hè micca cunnisciutu cù quale elementu cumincianu è finiscinu. Sicondu a maiò parte di i libri di testu, u lantanu, ancu s'ellu hà datu u nome à tutta a famiglia, ùn hè micca appartene à questu - hè scandalu di u gruppu 3I lantanidi sò metalli da u ceriu à u luteziu. Tuttavia, l'opinioni opposti indicanu chì l'ultimu membru di a famiglia scansa assai megliu. pregà. E so proprietà fisiche è a natura chimica di i cumposti resultanti currispondenu megliu à quelli di l'altri elementi di u gruppu 3 (cusì, i lantanidi sò metalli da u lantanu à l'itterbiu). I discussioni trà i chimichi cuntinueghjanu à questu ghjornu, è l'autori di i libri presentanu a situazione di questi elementi in modu diffirenti (2).
2. A forma più longa di a tavola periodica. I lantanidi è l'actinidi cumincianu ghjustu dopu à u gruppu 2, è scandlers include lutetium è laurens.
Prublemu # 2: actinidi
actinidi, vale à dì, elementi da actinium à Laurence, custituiscenu un gruppu simili à i lanthanides, posti in u periodu dopu. U prublema cù l'actinidi era è ferma u listessu cum'è cù i lanthanides. Mendeleev hà sappiutu solu dui actinides è li hà listatu senza difficultà in a tavula (3). TR cù a valenza più forte, u gruppu IV andò à u gruppu di titaniu è zirconiu, è u gruppu VI cù u valore uraniu trovu in cumpagnia di cromu, molibdenu è tungstenu.
I scuperti à u turnu di i seculi XNUMXth è XNUMXth scossa u sistema: ci hè apparsu una decina di elementi radiuattivi. Qualchidunu di elli avianu a stessa massa, ma diverse proprietà, mentri àutri avianu i stessi proprietà - diverse masse. Stu fattu cuntradite a cunniscenza previa, ma a scuperta di isotopi clarificava certi prublemi. A maiò parte di l'elementi sò stati mischii di atomi cù massi diffirenti (ma, sicuru, cù u listessu numaru di protoni in u nucleu). Riturnendu à l'actinidi, dui di elli apparsu à u principiu di u seculu passatu. Actinium subitu turnò à esse simili à lantanu (a so radiuattività hè stata truvata in i sedimenti di lanthanides precipitati da suluzioni chì cuntenenu actinium), è u protactinium cascò in u gruppu cù vanadium, niobium è tantalu cum'è un elementu V-value. Finu à l'anni 40, i primi quattru actinidi eranu tranquillamente situati in gruppi da 3 à 6.
3. L'actinidi più cumuni: à a manca hè u toriu, coperto cù una capa di diossidu, à a diritta hè uraniu ()
U prublema hè stata durante l'implementazione di u Prughjettu Manhattan. I fisici è i chimichi eranu sicuri chì anu pruduttu elementi più pesanti cà l'uraniuin ogni modu, ùn anu pussutu detect a so prisenza per i mezi chimichi. Per esempiu: l'elementu 93 vicinu à l'uraniu ùn si cumportanu micca cum'è un membru di u gruppu 7. Era solu u suggerimentu di Glen Seaborg, un scupertu dopu di parechji elementi transuraniu, chì l'elementi chì cumincianu cù l'actiniu formanu fila simili à i lanthanides risolve u prublema (4). ). L'usu di i metudi sviluppati per a separazione di lanthanides, principarmenti a cromatografia, hà permessu in l'anni successivi di identificà elementi artificiali. A perfezione di a tecnulugia è a cumpetenza di l'esperimenti hè pruvata da u fattu chì a prisenza di qualchi elementi novi hè stata scuperta cù solu una decina di i so atomi! (5).
Ma ùn crede micca chì u toriu o l'uraniu hà cambiatu di colpu e so proprietà è diventanu metalli trivalenti simili à lanthanide. Hanu sempre più in cumunu cù i titanidi è u cromu chì cù l'altri actinidi. In listessu modu cù i protactinati è ancu certi transuranisti. Pudemu parlà solu di una certa similarità in a seconda mità di a serie. In ogni casu, i lantanidi è l'actinidi ùn ponu micca dì chì sò famiglie parenti (cum'è se a so piazzamentu nantu à a tavula periodica suggerisce a so situazione).
4. Glenn Seaborg (1912-99) dà u simbulu per l'elementu chjamatu dopu à ellu.
5. U locu di nascita di parechji transuranisti hè u cyclotron à u Laboratoriu Naziunale di Lawrence Berkeley (Aostu 1939)
Nisuna dati sperimentali
A cunniscenza imprecisa di e pruprietà di i transuranidi più pesanti hè assuciata cù una quantità insufficiente di materiale per a ricerca. L'ultimu elementu per esse pruduciutu in una quantità notevuli di milligrami hè einstein, classificatu 99th nantu à a tavula. Di sicuru, esperimenti sò ancu realizati cù altri transuranidi, ma in u so casu, per esempiu, a radiazione caratteristica chì sorge in u precipitatu hè studiata, è a furmazione di cristalli di i cumposti ùn hè micca osservatu.
Pruprietà fisicochimiche Ùn pò micca esse misuratu solu, ma solu stimatu da osservazioni indiretti. Un prublema simili si trova cù dui elementi più ligeri: astatu (nr. 85) i Francese (nr. 87). A causa di a so vita curta, i quantità visibili ùn sò micca stati ottenuti, è a teoria deve cumprità i spazii in l'osservazioni è e misurazioni. Per d 'altra banda, a pruduzzione annuale di plutoniu, chì si trova in traccia di quantità in a crosta di a terra, hè parechje tunnellate è hè megliu cumpresu da parechji elementi persistenti più ligeri.
Un prublema ancu più grande hè cù l'elementi più pesanti cù un periodu di 7 dopu l'actinidi. In u so casu, unu deve operà cù atomi literalmente separati, a vita di quale hè calculata in frazioni di un secondu. Ùn hè più pussibule di determinà a radiuattività presente in u precipitatu di un compostu ligatu à un elementu, ma solu per investigà certe proprietà fisiche (cum'è a rata di depositu nantu à una superficia data) è cusì tirà cunclusioni nantu à a similarità chimica. Di sicuru, a teoria aiuta, o piuttostu i calculi basati nantu à a meccanica quantistica. In ogni casu, i risultati ùn sò micca 100% affidabili, per esempiu, secondu una certa distribuzione di l'elettroni nantu à e cunchiglia, a descrizzione di e proprietà chimiche hè sempre luntanu. Quantu più alluntanassi da i dati d'osservazione diretta, u più inaffidabile diventa a cunclusione di u "Metudu di Mendeleev" (vale à dì, basatu nantu à e proprietà di elementi cunnisciuti).
I chimichi è i fisici cercanu di predichendu e proprietà ancu di l'elementi più pesanti, ma micca ottenuti di u prossimu periodu. Elementi 119 è 120 prubabilmente averebbe caratteristiche micca assai diffirenti da quelli situati sopra francium è radiu (in i gruppi 1 è 2, u cambiamentu di e proprietà fisicochimiche hè abbastanza naturali). In u periodu 8, cum'è i lantanidi è l'actinidi, ci saranu quant'è 18 proprietà assai simili di l'elementi g-block chì i scientisti ùn anu ancu trattatu.
I calculi suggerenu l'esistenza di elementi cù una valenza di sin'à 12 durante stu periodu.Probabilmente, l'elementu 164 serà in u sistema, per i più pesanti a carica nucleare serà cusì grande chì l'elettroni cascanu nantu à elli, è a velocità orbitale sopra. a vitezza di a luce. I calculi realizati ùn danu micca risultati senza ambiguità, alcuni cambianu i cunfini di a tavola periodica da circa una decina d'elementi.
A lege di periodicità in a basura ?
Dopu avè lettu l'articulu, avete probabilmente ghjuntu à a cunclusione chì un gran numaru d'eccezzioni da e regule datu à a scola, questu vi dà u dirittu di risponde à a quistione in l'affirmative. Ma ùn dà micca troppu prestu. Legge di periodicità hè formulatu in modu assai generale (i pruprietà sò ripetuti periòdicamenti), chì hè u so vantaghju è u so svantaghju. U vantaghju, infatti, analizendu a pusizione di un elementu in una tavula custruita nantu à a basa di a lege, si pò piglià cunclusioni nantu à e so proprietà fisiche è chimiche. Un svantaghju, postu chì e cunclusioni sò spessu imprecisi o ancu falsi.
Legge di periodicità travaglia bè in i gruppi principali (1, 2, 13-18), megliu in i so parti superiori cà in i so parti inferjuri. Un esempiu perfettu hè u periodu 3: da u sodiu à l'argon, a valenza è e proprietà chimiche cambianu regularmente senza sorprese. In i gruppi laterali (3-12) i deviazioni sò digià chjaramente visibili, ma leghjite nantu à i prublemi cù lanthanides è actinides sopra. In generale, u più luntanu da u principiu di u sistema, u menu esattamente a lege di periodicità hè soddisfatta.
Allora in a basura ? Universu di elementi chimichi è e relazioni chì creanu sò un sistema cusì cumplessu chì ancu l'idea brillanti di Mendeleev ùn pò micca catturà sanu sanu. A lege certamenti deve esse curretta è chjarificata. Se paragunemu Mendeleev cù Newton (perchè sia a lege di a periodicità è a teoria di a gravità urganizata è spiegà grandi pezzi di u mondu intornu à noi), pudemu cuncludi chì i chimichi sò sempre aspittendu u so Einstein.
Vede ancu:

